Sahabat baca pojok kimia, Ujian Nasional 2020 sedikit lagi akan dimulai. Mempersiapkan diri dengan latihan soal tentunya sangat bermanfaat untuk dapat mencapai prestasi yang di inginkan. Pada postingan sebelumnya saya sudah share beberapa file soal, nah pada kesempatan kali ini saya berbagi dalam pembahasan soal khusunya pembahasan soal Kimia. bagi yang belum mendapatkan soalnya silakan di klik UNDUH disini
Berikut pembahasan soal lengkapnya :
Soal Nomor 1:Berikut pembahasan soal lengkapnya :
Perhatikan gambar dan beberapa pernyataan tentang model atom berikut!

- Tidak dapat menjelaskan spektra atom hidrogen.
- Tidak dapat menerangkan pengaruh medan magnet terhadap spektrum atom.
- Tidak dapat menjelaskan tingkat-tingkat energi atom hidrogen.
- Tidak dapat menerangkan struktur atom berelektron banyak.
Pasangan pernyataan yang benar tentang kelemahan model atom
tersebut adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Jawaban: D
Pembahasan:
Model atom di atas merupakan model atom Bohr.
Teori
Atom Bohr
- Elektron-elektron dalam atom mengorbit nucleus dengan gaya elektrostatik.
- Elektron-elektron hanya dapat mengorbit secara stabil, tanpa radiasi, pada orbit tertentu (disebut orbit stasioner) pada sebuah set diskrit jarak tertentu dari nukleus. Orbit ini diasosiasikan dengan kulit energi atau tingkat energi. Pada orbit ini, percepatan elektron tidak menghasilkan radiasi dan hilangnya energi. Model atom ini didasarkan pada teori kuantum Planck tentang radiasi.
- Elektron hanya dapat mendapatkan atau kehilangan energi dengan cara melompati orbit yang diperbolehkan, ke orbit yang lain. Perpindahan elektron menyerap energi apabila lompat dari kulit dalam ke kulit luar, sebaliknya membebaskan energi apabila lompat dari kulit luar ke kulit dalam. Elektron menyerap atau memancarkan radiasi elektromagnetik dengan frekuensi v ditentukan dengan perbedaan tingkat energi sesuai dengan persamaan Planck: ΔE=E2–E1=hv di mana h adalah konstanta Planck, dan T adalah periode orbit.
1.
Melanggar asas ketidakpastian Heisenberg karena elektron
mempunyai jari-jari dan lintasan yang telah diketahui
2.
Model atom Bohr mempunyai nilai momentum sudut lintasan ground state yang salah
3.
Lemahnya penjelasan tentang prediksi spektra atom yang lebih
besar.
4.
Tidak dapat memprediksi intensitas relatif garis spektra.
5.
Model atom Bohr tidak dapat menjelaskan struktur garis spektra
yang baik.
6.
Tidak dapat menjelaskan efek Zeeman. Efek Zeeman adalah
pemisahan sebuah garis spektrum menjadi beberapa komponen disebabkan oleh
adanya medan magnet.
Soal Nomor 2:
Massa rata-rata satu atom P adalah 6,64 x 10-23 gram, sedangkan massa satu atom karbon C-12
adalah 1,992 x 10-23 gram. Massa atom
relatif (Ar) untuk unsur P adalah …
Jawaban: C
Pembahasan:
Soal Nomor 3:
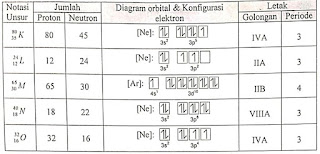
Perhatikan hubungan notasi unsur, konfigurasi elektron, dan
letaknya dalam tabel periodik unsur
berikut!
Data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur
….
A. K
B. L
C. M
D. N
E. O
Jawaban: D
Pembahasan: Perhatikan ilustrasi berikut :
Pada atom netral, Jumlah Proton = Jumlah Elektron
Pada tabel diatas, yang memiliki jumlah proton dan jumlah
elektron sama terdapat pada unsur L dan
unsur N. Namun, pada unsur L konfigurasi elektronnya salah. Harusnya cukup
sampai 3s2. Sehingga unsur L salah dan unsur N. Elektronnya
berjumlah 18, sehingga konfigurasi elektronnya, jumlah nomor massa serta golongan dan periode seperti pada tabel.
Soal Nomor 4:
Unsur Y termasuk
unsur transisi dan memiliki notasi 24Y52. Konfigurasi elektron Y pada keadaan dasar adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d5
C. 1s2 2s2 2p6 3s2 3p6 3d6
D. 1s2 2s2 2p6 3s2 3p6 4s0 4p4
E. 1s2 2s2 2p6 3s2 3p6 4s0 4d5
Jawaban: A
Pembahasan:
Pengisian elektron dalam konfigurasi elektron didasarkan pada
acuan berikut:
Dalam keadaan dasar, maka konfigurasi
elektron Y adalah sebagai erikut: 1s2 2s2 2p6 3s2 3p6 4s2 3d4
Namun, pada keadaan ini pada 4s2 3d4 konfigurasi elektron kurang stabil sehingga konfigurasi
elektron Y yang paling stabil adalah sebagai :1s2 2s2 2p6 3s2 3p6 4s1 3d5
Soal Nomor 5:
Proses industri pembuatan amonia dapat dibuat dari reaksi antara
gas nitrogen dan hidrogen, dengan persamaan reaksi: N2(g) + H2(g) → NH3(g) ∆H = -92,4
kJ
Reaksi berlangsung pada suhu dan tekanan tinggi dengan
menggunakan katalisator serbuk Fe di campur dengan Al2O3, MgO, CaO, dan K2O. Perbandingan volume gas-gas yang bereaksi dan
hasil reaksi pada P dan T yang sama ternyata 1 : 3 dan 2.
Berdasarkan wacana
tersebut, hukum kimia yang berlaku adalah ….
A. Hukum Dalton
B. Hukum Gay-Lussac
C. Hukum Avogadro
D. Hukum Lavoisier
E. Hukum Proust
Jawaban: B
Pembahasan:
Hukum Gay Lussac berbunyi “Pada suhu dan tekanan yang
sama, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding
sebagai bilangan bulat dan sederhana”.
Reaksi kimia: N2(g) + H2(g) → NH3(g)
Persamaan reaksi belum setara sehingga jika setarakan, maka akan menghasilkan reaksi kimia
sebagai berikut: N2(g) + 3H2(g) → 2NH3(g)
Sehingga menghasilkan perbandingan 1 : 3 dan 2.
Soal Nomor 6:
Larutan asam nitrat pekat (Mr = 63) tersedia di laboratorium
dengan konsentrasi 16,43 M. Bila massa jenis larutan asam nitrat pekat yang
tertera pada kemasannya adalah 1,643 g/mL, kadar (% massa) asam nitrat dalam
larutan tersebut adalah ….
A. 39,69%
B. 53,86%
C. 58,36%
D. 63,00%
E. 81,60%
Jawaban: D
Pembahasan:
M = (% . ρ . 10) / Mr
% = (M . Mr) / (10 . ρ)
= (16,43 . 63) / (10 .
1,643)
= 63%
Soal Nomor 7:
Amonium nitrat adalah suatu senyawa kimia yang memiliki rumus
kimia NH4NO3. Senyawa ini
utamanya digunakan dalam pertanian sebagai pupuk kaya nitrogen.
Produksi industri amonium nitrat secara sederhana sebagai
berikut:
HNO3(aq) + NH3(g) → NH4NO3(s)
Reaksi antara 12,6 gram asam nitrat dan 2,24 L gas amoniak pada
STP menghasilkan massa padatan NH4NO3 sebesar …. (Ar N = 14, H = 1, O = 16)
A. 0,4 gram
B. 0,8 gram
C. 4 gram
D. 8 gram
E. 16 gram
Jawaban: D
Pembahasan:
Langkah 1 : Perhatikan persamaan reaksi harus setara.
Langkah 2 : tentukan jumlah mol setiap pereaksi.
n HNO3 = gr/Mr
n HNO3 = 12,6/63 = 0,2 mol
n NH3 = V/VSTP
n NH3 = 2,24/22,4 = 0,1 mol
Karena nilai mol NH3 lebih kecil
dari nilai mol HNO3, maka NH3 berfungsi sebagai pereaksi pembatas.
Sehingga dalam perhitungan pereaksi pembatas akan berfungsi untuk menentukan mol zat lainnya,
n NH4NO3 = n NH3 [koefisien sama]
n NH4NO3 = 0,1 mol
Setelah ketemu jumlah mol NH4NO3, sekarang tinggal kita tentukan massa padatan NH4NO3.
gr NH4NO3 = n x Mr
gr NH4NO3 = 0,1 x 80
= 8 gram
Soal Nomor 8:
Iodium biasanya digunakan dalam larutan beralkohol untuk
sterilisasi kulit sebelum dan sesudah tindakan medis. Namun larutan ini tidak
lagi direkomendasikan untuk mendisinfeksi luka ringan karena dapat mendorong
pembentukan jaringan parut dan memperlama waktu penyembuhan. Saat ini
terdapat iodine povidone, sebuah polimer larut air yang
mengandung sekitar 10% massa yodium aktif. Konsentrasi iodin tersebut
dinyatakan dalam molaritas adalah ….
(Massa jenis larutan = 1 g/mL, Ar I = 127)
A. 7,9 . 10-4 M
B. 8,7 . 10-4 M
C. 79 . 10-2 M
D. 87 . 10-2 M
E. 1. 102 M
Jawaban: C
Pembahasan:
M = ρ x % massa x 10 / Mr
M = 1 x 10 x 10 / 127
M = 0,787 M
M = 79 . 10-2 M
Soal Nomor 9:
Perhatikan tabel berikut!
Pasangan data yang tepat antara mineral dan kandungan unsurnya
adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 3 dan 4
E. 4 dan 5
Jawaban: B
Pembahasan:
Perhatikan tabel hubungan antara mineral dan unsur yang tepat :
Soal Nomor 10:
Bahan yang digunakan pada pengolahan besi selain bijih besi (Fe2O3) adalah kokas
(C) dan batu kapur (CaCO3).
Berikut beberapa pernyataan yang berkaitan dengan proses
pembuatan logam besi.
1.
Reaksi berlangsung pada suhu 9000C
2.
Kokas berfungsi sebagai oksidator.
3.
Batu kapur berfungsi sebagai fluks.
4.
Proses berlangsung pada tanur tinggi.
Pasangan pernyataan berkaitan dengan pengolahan besi tersebut
adalah …
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Jawaban: E
Pembahasan:
Hal-hal yang berkaitan dengan proses pengolahan besi adalah
sebagai berikut:
1. Reaksi endoterm berlangsung pada suhu 13000C dan reaksi eksoterm berlangsung pada suhu 19000C
2. Kokas berfungsi sebagai reduktor
3. Batu kapur digunakan sebagai fluks, yaitu mengikat pengotor pada
bijih besi
4. Proses berlangsung pada tanur tinggi
Halaman Selanjutnya >>>>>>>>>









0 komentar:
Posting Komentar